Sommario
Introduzione
Il gravitropismo
L’inclinazione dei rami
I meccanismi cellulari e molecolari (per i più curiosi)
– I siti di percezione del segnale gravitazionale
– La risposta gravitropica delle radici
– La risposta gravitropica dei fusti
– La ricezione e la trasduzione del segnale dell’auxina
Introduzione
Sebbene in natura non esistano due alberi perfettamente identici, ogni specie ha una propria sagoma, fisionomia, portamento che la rende spesso riconoscibile anche a distanza. Ad esempio, la chioma è conica nei tigli, colonnare nel pioppo cipressino, globoso-sferica nel bagolaro, globosa-ovale nell’ippocastano, espansa nella rovere ecc. (Fig. 1).
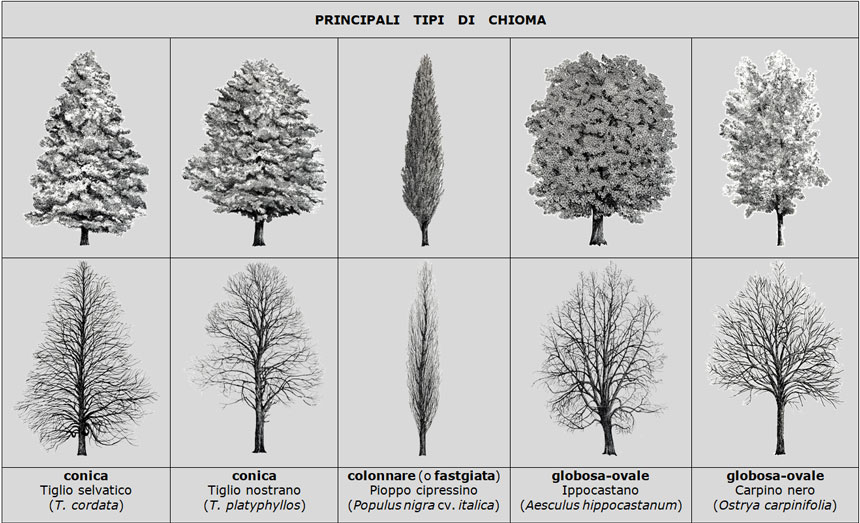
 Fig. 1. Esempi dei principali tipi di chioma (nella prima riga di ogni specie) e (nella seconda riga) lo scheletro arboreo nella veste invernale, dopo la caduta delle foglie. La forma della chioma è fondamentalmente determinata dalla diversa lunghezza dei rami inferiori, medi e superiori e dall’angolo tra i rami figli e il loro ramo padre: angoli molto stretti generano una chioma colonnare (es. pioppo cipressino), angoli più grandi generano una chioma espansa (es. rovere). Le dimensioni non sono in scala. Fonte delle illustrazioni: Lombardi C., Stagi F. L’architettura degli alberi. Ed. Mazzotta, Milano, 1982, 392 pp.
Fig. 1. Esempi dei principali tipi di chioma (nella prima riga di ogni specie) e (nella seconda riga) lo scheletro arboreo nella veste invernale, dopo la caduta delle foglie. La forma della chioma è fondamentalmente determinata dalla diversa lunghezza dei rami inferiori, medi e superiori e dall’angolo tra i rami figli e il loro ramo padre: angoli molto stretti generano una chioma colonnare (es. pioppo cipressino), angoli più grandi generano una chioma espansa (es. rovere). Le dimensioni non sono in scala. Fonte delle illustrazioni: Lombardi C., Stagi F. L’architettura degli alberi. Ed. Mazzotta, Milano, 1982, 392 pp.
La forma della chioma è determinata dalla sua architettura: il numero dei rami, la lunghezza relativa dei rami superiori, intermedi e inferiori, l’angolo tra le branche e la forza di gravità (verticale rispetto all’orizzonte), l’angolo tra un ramo di un dato ordine e il suo ramo ‘genitore’, la curvatura dei rami con l’età, ecc. Nelle caducifoglie l’architettura è meglio apprezzabile nell’autunno-inverno, poiché la caduta delle foglie mette a nudo l’intera ramificazione (Fig. 1).
Per quanto possa apparire sorprendente, l’insieme di tali caratteristiche è determinato e continuamente regolato in una piccola regione (dell’ordine del millimetro) situata nell’apice del fusto e dei germogli principali.
Nella scheda
Durante un viaggio in treno, il professor Stefan Kepinski, biologo dell’università di Leeds (Inghilterra), osservando dal finestrino la sagoma caratteristica di diverse specie di alberi, ampiamente influenzata dall’angolo dei loro rami, si chiese quale ne fosse il meccanismo responsabile. Ne scaturì un filone di ricerca, ancora pienamente attivo, volto a comprendere come le piante riescano a impostare e a mantenere uno specifico angolo, tipico della specie, tra i loro rami.
Essendo nota da tempo la sensibilità delle piante alla gravità –che porta il fusto a svilupparsi in verticale verso l’alto e le radici verso il basso– le ricerche sono partite dal gravitropismo. Al momento le ricerche sulle radici sono ad uno stadio più avanzato di quelle sui germogli.
Il gravitropismo
Il gravitropismo (o geotropismo) Gravitropismo (o geotropismo): dal latino gravis (grave) o dal greco geos (terra) e dal greco trépo (volgere): proprietà di organi vegetali di orientarsi secondo la direzione della forza di gravità.
Si dice positivo se l’organo è orientato verso il centro della terra (come avviene per la radice primaria), negativo (o antigravitropismo) se è orientato in senso opposto (come avviene per il fusto primario), diageotropismo (dal greco dia = attraverso) se orientato trasversalmente alla gravità, cioè orizzontalmente, plagiogeotropismo (dal greco plagi = obliquo, trasverso) se orientato obliquamente, ageotropismo se non risponde alla forza di gravità. è la proprietà di organi vegetali di orientarsi secondo la direzione della forza di gravità.
 Fig. 2. Gli alberi di montagna cresciuti su ripidi pendii mantengono la posizione eretta, ma presentano spesso una curvatura al piede, generalmente dovuta all’inclinazione indotta dal peso della neve nella fase giovanile. Il successivo raddrizzamento testimonia il gravitropismo positivo del fusto. Foto di Mathieu Rodriguez (in https://en.wikipedia.org/wiki/File:Gravitropism_tree.jpg).
Fig. 2. Gli alberi di montagna cresciuti su ripidi pendii mantengono la posizione eretta, ma presentano spesso una curvatura al piede, generalmente dovuta all’inclinazione indotta dal peso della neve nella fase giovanile. Il successivo raddrizzamento testimonia il gravitropismo positivo del fusto. Foto di Mathieu Rodriguez (in https://en.wikipedia.org/wiki/File:Gravitropism_tree.jpg).È ben noto che l’embrione contenuto in un seme sviluppa una radichetta che si dirige in profondità nella terra (gravitropismo positivo) e un germoglio che si dirige verso l’alto (gravitropismo negativo): ciò dimostra che la sensibilità alla gravità è presente già nell’embrione.
Questa sensibilità è mantenuta anche negli alberi adulti: lo dimostra il fatto che il tronco degli alberi cresciuti su un ripido pendio ha spesso una curvatura al piede, derivante dall’inclinazione della giovane piantina (solitamente piegata dal peso della neve accumulata sul suolo) e dalla successiva crescita che recupera la verticalità (Fig. 2).
Il gravitropismo può essere osservato sperimentalmente con facilità: basta disporre in orizzontale una piantina in vaso per vedere che il fusto cresce incurvandosi verso l’alto e la radice verso il basso (Fig. 3).
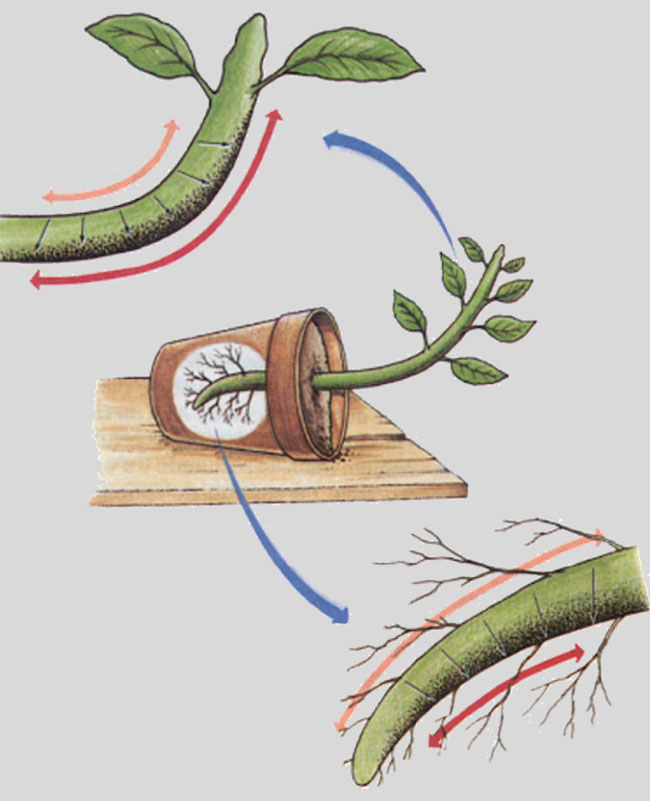
Fig. 3.
Semplice esperimento per osservare il geotropismo.
Sdraiando un vaso in orizzontale, il fusto si incurva verso l’alto e la radice verso il basso.
Ciò si ottiene grazie ad un maggior allungamento delle cellule del lato inferiore (nel fusto) o del lato superiore (nella radice).
La concentrazione di auxina è rappresentata dal colore delle frecce a doppie punte: arancione per concentrazioni basse e rosso per concentrazioni elevate. La lunghezza delle frecce indica l’entità dell’allungamento.
Si noti che la maggior concentrazione di auxina (freccia rossa) si verifica sul lato inferiore, ma determina effetti opposti nel fusto (curvatura verso l’alto: freccia rossa più lunga) e nelle radici (curvatura verso il basso: freccia rossa più corta).
Figura da: Anna Frida Hautse Modro, 2014. Morfologia e anatomia da raiz.
Queste curvature sono prodotte dall’allungamento differenziale delle cellule che vengono a trovarsi sul lato inferiore e sul lato superiore. Nel caso della radice principale e del fusto, entrambi a crescita verticale, il meccanismo è ben compreso: cellule sensoriali di gravità, chiamate statociti statocitiStatocito: da stato- e –cito, dal greco statós = ‘che sta ritto’ e kýtos = cavità, cellula. Cellule capaci di percepire la propria posizione nello spazio, cioè rispetto alla verticale., rilevano che la pianta è stata inclinata e inducono sul lato inferiore un aumento dell’ormone auxina che, nel fusto, stimola l’allungamento cellulare su tale lato (guidando la crescita verso l’alto) e, nella radice, stimola l’allungamento sul lato superiore (guidando la crescita verso il basso). Una volta ripristinata la crescita verticale, queste cellule equilibrano l’invio di auxina ad entrambi i lati, interrompendo così la flessione.
L’inclinazione dei rami
Come si è detto, l’aspetto di un albero deriva in gran parte dall’angolo d’inserzione tra i rami e il tronco. In un cipresso questo angolo è molto stretto, perciò la chioma è appressata al tronco e assume un aspetto colonnare; in una quercia, invece, l’angolo è ampio e la chioma assume un aspetto espanso.
Più esattamente, osservando l’angolo dei rami di alberi col tronco inclinato, si è visto che i rami di ciascuna specie ripristinano un angolo caratteristico non tanto con il tronco, quanto con la verticale, cioè con la forza di gravità (definito perciò angolo di crescita gravitazionale, tipico della specie).
I rami laterali, così come le radici di secondo e terzo ordine, si allontanano così dalla verticale formando angoli compresi tra 0 e 90° (plagiogravitropismo). Questa disposizione permette lo sviluppo di un apparato radicale che assicura un buon ancoraggio e una buona penetrazione e distribuzione delle radici nel suolo. Allo stesso modo, permette ai rami di espandere la chioma e ridurre al minimo l’ombreggiatura, ottimizzando la cattura della luce.
Ogni specie, si sa, cresce e si differenzia secondo le informazioni contenute nel DNA; ma come fanno le piante a mantenere quegli specifici angoli tra rami e tronco e tra radici secondarie e principale?
Studiando l’arabetta comune (Arabidopsis thalianaArabidopsis thaliana, detta arabetta comune, è una piccola pianta della famiglia Crucifere (o Brassicacee), molto studiata poiché utilizzata come ‘organismo modello’ per le scienze vegetali (genetica, biologia molecolare e cellulare).
Tale scelta è dovuta alle sue piccole dimensioni, al rapido ciclo di sviluppo, alla facilità di ottenere piante transgeniche e alle dimensioni relativamente contenute del suo genoma (circa 5 milioni di paia di nucleotidi in soli 5 cromosomi) che ne ha consentito il sequenziamento e la creazione di mappe genetiche.
Da allora il punto focale della ricerca è diventato scoprire qual è la funzione di ognuno dei circa 26500 geni contenuti.) i ricercatori dell’università di Leeds hanno dimostrato che nei rami laterali della pianta l’ormone auxina stimola una crescita anche sul lato opposto di quello interessato dal gravitotropismo. In sostanza, l’angolo di crescita dei rami dipende dal bilanciamento tra il gravitotropismo, che tende a far crescere il ramo il più verticale possibile, e l’anti-gravitotropismo, che tende a farlo crescere più orizzontalmente.
Nel cipresso, dunque, i rami crescono verticali poiché l’intensità dell’anti-gravitropismo (codificata nel DNA) è molto debole, mentre nel faggio e nella quercia la chioma è espansa lateralmente perché l’anti-gravitropismo prevale sul gravitropismo. In generale, il bilanciamento tra i due fenomeni, uno che spinge verso l’alto e l’altro che spinge verso il basso, permette ai rami di svilupparsi in diagonale, secondo un angolo tipico per ciascuna specie.
L’anti-gravitropismo è stato dimostrato con un esperimento semplice ed elegante, usando un clinostato. Fissando una piantina in posizione orizzontale ad un supporto lentamente rotante lungo l’asse orizzontale, ogni ramo (così come ogni radice laterale) veniva a trovarsi orientato alternativamente verso l’alto e verso il basso (e nelle posizioni intermedie), annullando in tal modo l’azione media della gravità.
In queste condizioni è stato osservato che i rami (e le radici laterali) crescevano verso l’esterno, allontanandosi dall’asse principale della pianta (effetto anti-gravitropico). Nelle piante cresciute in condizioni naturali questo angolo viene ridotto dal gravitropismo e il bilanciamento tra i due effetti determina l’angolo di crescita gravitazionale tipico di ogni specie.
I meccanismi cellulari e molecolari (per i più curiosi)
Così come il gravitropismo (che permette al germoglio del seme di salire verso la luce e alla radichetta di penetrare in profondità a cercare acqua e nutrienti), l’angolo di crescita dei rami e delle radici è un adattamento molto importante perché determina la capacità della pianta di catturare la luce solare (riducendo l’ombreggiamento delle piante vicine) e di approvvigionarsi di acqua e degli elementi nutritivi minerali (orientando le radici a sfruttare l’intero spessore del suolo).
Le attuali conoscenze derivano da un fiorente campo di ricerca in corso, per il momento su piccole piante erbacee (arabetta comune, piselli, fagioli, riso): gli esperimenti hanno permesso di osservare gli stessi risultati. Negli alberi legnosi i meccanismi guida di risposta alla gravità sono diversi da quelli delle piante non legnose, ma i ricercatori ritengono che si possano applicare gli stessi principi generali.
Scendendo in profondità nei meccanismi cellulari e molecolari si scopre un mondo meraviglioso in cui la gravità influenza gli organuli e le strutture cellulari dando luogo ad una complessa catena di risposte il cui risultato finale è l’effetto visibile della curvatura dei rami e delle radici.
I processi molecolari che sottendono alla percezione del segnale e alle risposte gravimetriche sono stati chiariti da studi su organi ortogravitropici (radici primarie, ipocotili, coleottiliIpocotile: parte assile dell’embrione e della piantina germinata, posta al di sotto dei cotiledoni fino al colletto della radice.
Epicòtile: primo internodo del fusto, compreso tra i cotiledoni e la prima foglia: è la diretta continuazione dell’ipocotile.
Cotiledone: foglia embrionale presente, o abbozzata, nel seme delle piante. I cotiledoni sono singoli nelle Monocotiledoni, due nelle Dicotiledoni, da due-tre a diciotto nelle Gimnosperme.
Coleottile: la prima foglia che si sviluppa sul fusto delle graminacee, in forma di guaina avvolgente la gemma caulinare come una membrana a sacco; essa perfora il terreno durante la germinazione e quindi si apre lateralmente per lasciare uscire il germoglio.
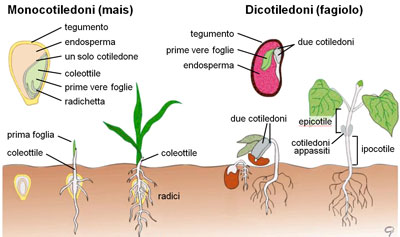
Organi della plantule nelle Monocotiledoni e nelle Dicotiledoni. e scapi fiorali).
– I siti di percezione del segnale gravitazionale
La localizzazione dei siti di percezione del segnale gravitazionale è stata individuata mediante esperimenti di rimozione chirurgica: rimuovendo la cuffia che protegge l’apice radicale, infatti, la radice continuava a crescere, ma perdeva la capacità di rispondere alla gravità. Più esattamente, la percezione risiede nelle cellule della columella (sotto la cuffia), soprattutto del secondo strato di cellule, dette perciò statociti Statocito: da stato- e –cito, dal greco statós = ‘che sta ritto’ e kýtos = cavità, cellula.
Cellula capace di percepire la propria posizione nello spazio, cioè rispetto alla verticale. (Fig. 4).
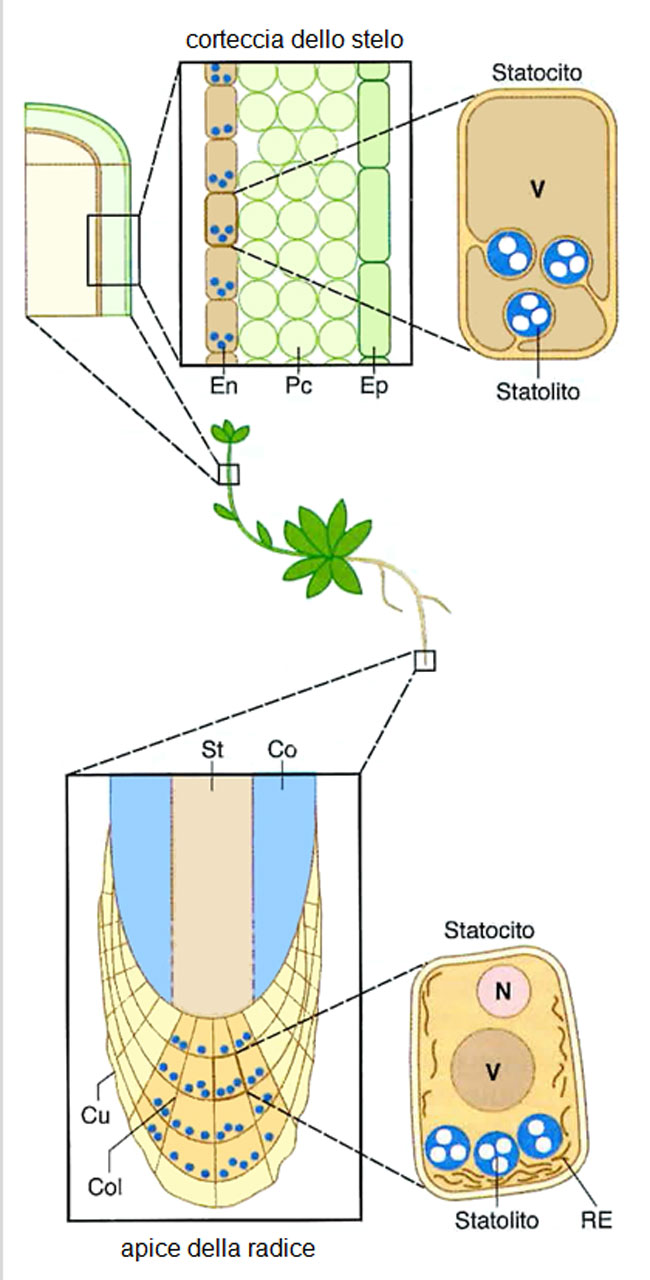
Fig. 4.
Schema dei siti di percezione ortogravitazionale (cioè parallela alla forza di gravità) nel fusto e nella radice.
Nel fusto la percezione ha luogo nelle cellule (statociti) dell’endodermide (En) che contengono pesanti statoliti imbrigliati tra masse vacuolari.
Nella radice il sito di percezione è la columella (Col: area marrone chiaro) della cuffia (Cu: area gialla + marrone chiaro), le cui cellule (statociti) contengono pesanti amiloplasti (statoliti) mobili nel citosol.
Co = cilindro corticale
Ep = epidermide
N = nucleo
Pc = parenchima corticale
RE = reticolo endoplasmatico
St = stele
V = vacuolo
Figura tratta da:
N. Rascio, Elementi di fisiologia vegetale. EdiSES, Napoli, 2017.
Poiché l’unico modo per percepire la gravità è attraverso il movimento di un corpo in caduta o in sedimentazione, come ovvi candidati a sensori di gravità nelle piante si è pensato ai grandi e densi amiloplasti Amiloplasti: plastidi che –a differenza dei cloroplasti che compiono la fotosintesi nelle cellule delle foglie– accumulano amido, diventando in tal modo voluminosi e pesanti presenti nelle cellule che percepiscono la gravità (statociti).
Gli statociti hanno una organizzazione subcellulare polarizzata: il nucleo è nella regione prossimale (superiore); alla periferia ci sono il reticolo endoplasmatico (costituito da un reticolo tubulare) e organelli, tra cui amiloplasti (detti statoliti Statoliti: da stato- e –lito, dal greco statós = ‘che sta ritto’ e lithos = pietra.
Organelli subcellulari pesanti, che tendono a cadere sul fondo della cellula, permettendo ad essa di percepire la gravità.) che, essendo molto voluminosi e pesanti, sedimentano sul lato distale (basso) della cellula.
Nei fusti, invece, il sito di percezione è l’endodermide amilacea, cioè lo strato di cellule più interno del cilindro corticale che circonda il cilindro centrale (stele) del germoglio (Fig. 4). Sebbene l’endodermide del fusto sia in continuità con quella della radice, solo nel fusto essa è costituita da statociti (cellule con amiloplasti statoliti).
Sia nel germoglio che nella radice, dunque, la gravità è percepita attraverso la caduta verso il basso degli statoliti, all’interno delle statociti. Resta da capire in quale modo la gravistimolazione attivi i meccanismi di trasduzione Trasduzione: processo di trasmissione di un segnale attraverso una modificazione della natura dell’energia trasmessa: per es., trasmissione di energia meccanica convertita in energia elettrica o viceversa (trasduzione elettromeccanica).
Nel caso specifico del gravitropismo, trasmissione del segnale meccanico degli statociti convertendolo in segnali molecolari: trasportatori di auxina AUX1, PIN2, PIN3, traffico vescicolare mediato dalla proteina GNOM ecc. del segnale che inducono la crescita differenziata degli organi per ripristinare il loro corretto posizionamento rispetto alla gravità.
Per produrre una risposta, lo stimolo gravitazionale deve superare una “dose soglia” (prodotto tra intensità dello stimolo, cioè angolo rispetto all’asse gravità, e tempo di applicazione). L’angolo soglia può essere basso (es. 10°) e il tempo minimo è circa 10-30 secondi, mentre il tempo di reazione (intervallo tra lo stimolo e l’attivazione degli eventi della curvatura) è di pochi minuti.
– La risposta gravitropica delle radici
In una radice posta orizzontalmente, lo stimolo gravitazionale è percepito dagli statociti della columella e induce una risposta che modula l’accrescimento delle cellule della zona di allungamento distale (DEZ: distal elongation zone) (sito di risposta). Esperimenti di rimozione parziale o totale della cuffia o di applicazione di sostanze chimiche o ormonali all’apice e lo studio di mutanti agravitropici hanno dimostrato che nella risposta di accrescimento è coinvolta principalmente l’auxina.
L’esatto meccanismo con cui gli statociti percepiscono lo spostamento degli statoliti non è ancora pienamente chiarito. Secondo un’ipotesi, avvalorata da numerose ricerche, il via alla risposta è dato dal contatto fra gli amiloplasti in sedimentazione e il reticolo endoplasmatico posto vicino alla membrana plasmatica nella parte inferiore della cellula.
Secondo il modello assiale, l’auxina prodotta nel germoglio viene trasportata verso l’apice radicale lungo la stele (il cilindro centrale), raggiunge le cellule della columella e da qui viene ridistribuita lateralmente per risalire (attraverso le regioni corticali ed epidermiche) verso la zona di allungamento distale della radice, di cui controlla la crescita (Fig. 5A).
Se la radice viene posizionata orizzontalmente, gli statoliti sedimentano in quella che è diventata la nuova regione basale delle cellule della columella, inducendo un flusso preferenziale di auxina verso la zona DEZ del lato inferiore, dove inibiscono la distensione delle cellule e inducono quindi la curvatura dell’organo verso il basso (Fig. 5B).
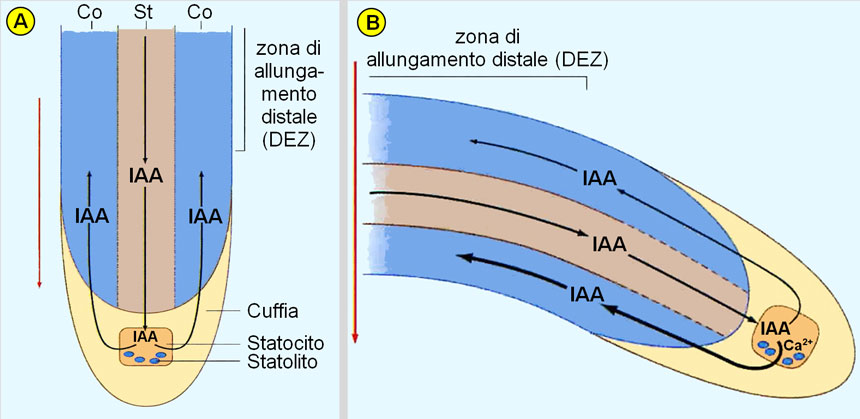 Fig. 5. Schema degli eventi coinvolti nel gravitropismo della radice. A: con la radice in posizione verticale, corrispondente alla direzione della forza di gravità, gli statoliti sono sedimentati nella regione basale delle cellule della columella (statociti), una delle quali è rappresentata nello schema. L’auxina (IAA: Indol Acetic Acid), che è scesa dal germoglio per trasporto polare attraverso le cellule parenchimatiche della stele, viene deviata dagli statociti, lateralmente e uniformemente, verso la zona di allungamento distale (DEZ), inducendo una crescita omogenea delle cellule radicali. B: con la radice posta in posizione orizzontale, gli statoliti sedimentano sul lato basso degli statociti (che è diventato la regione basale di queste cellule) e ciò induce il flusso preferenziale di auxina (IAA) verso la zona di allungamento distale (DEZ) del lato inferiore della radice. La maggiore quantità di auxina nel lato inferiore della radice (frecce di maggior spessore) inibisce la distensione cellulare mentre le cellule del lato superiore, prive di questa inibizione, si allungano maggiormente: ciò determina la curvatura della radice in direzione della forza di gravità (freccia verticale). Nella radice, dunque, l’auxina inibisce l’allungamento delle cellule, al contrario di quanto avviene nello stelo del germoglio (in cui favorisce l’allungamento cellulare). Figura tratta da: N. Rascio, Elementi di fisiologia vegetale. EdiSES, Napoli, 2017.
Fig. 5. Schema degli eventi coinvolti nel gravitropismo della radice. A: con la radice in posizione verticale, corrispondente alla direzione della forza di gravità, gli statoliti sono sedimentati nella regione basale delle cellule della columella (statociti), una delle quali è rappresentata nello schema. L’auxina (IAA: Indol Acetic Acid), che è scesa dal germoglio per trasporto polare attraverso le cellule parenchimatiche della stele, viene deviata dagli statociti, lateralmente e uniformemente, verso la zona di allungamento distale (DEZ), inducendo una crescita omogenea delle cellule radicali. B: con la radice posta in posizione orizzontale, gli statoliti sedimentano sul lato basso degli statociti (che è diventato la regione basale di queste cellule) e ciò induce il flusso preferenziale di auxina (IAA) verso la zona di allungamento distale (DEZ) del lato inferiore della radice. La maggiore quantità di auxina nel lato inferiore della radice (frecce di maggior spessore) inibisce la distensione cellulare mentre le cellule del lato superiore, prive di questa inibizione, si allungano maggiormente: ciò determina la curvatura della radice in direzione della forza di gravità (freccia verticale). Nella radice, dunque, l’auxina inibisce l’allungamento delle cellule, al contrario di quanto avviene nello stelo del germoglio (in cui favorisce l’allungamento cellulare). Figura tratta da: N. Rascio, Elementi di fisiologia vegetale. EdiSES, Napoli, 2017.
Scendendo ancor più in profondità (a livello intracellulare) possiamo comprendere i meccanismi molecolari coinvolti nel trasporto dell’auxina. Sebbene si tratti di una materia rivolta agli studiosi più che al largo pubblico, sarà qui affrontata (sia pur sinteticamente) affinché anche il lettore non esperto in materia possa cogliere almeno alcuni sprazzi di quanto siano meravigliosi i meccanismi della natura e la loro comprensione.
La traslocazione di auxina dal germoglio all’apice radicale non avviene per diffusione passiva, ma principalmente attraverso il trasporto polare che implica l’attività, nelle cellule coinvolte, di specifici trasportatori (carrier) di membrana, in particolare di carrier di influsso (che trasportano l’auxina all’interno delle cellule) appartenenti alla famiglia proteica AUX e di carrier di efflusso (che trasportano l’auxina all’esterno delle cellule) della famiglia PIN (Fig. 6).
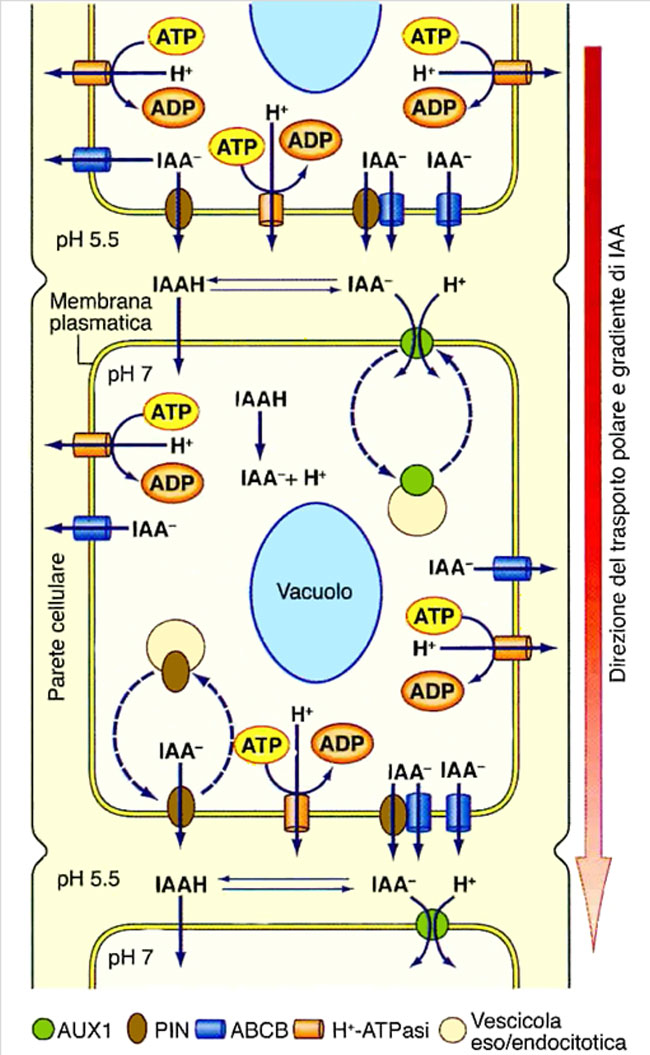
Fig. 6. Schema del trasporto polare dell’auxina (IAA) nella radice.
Il flusso direzionato dell’ormone lungo le cellule dipende dalle conversioni IAAH IAA– + H+, causate dai valori di pH intracellulari ed extracellulari, dovuti all’attività delle H+-ATPasi della membrana plasmatica e dalla distribuzione in questa membrana dei trasportatori di influsso (AUX1) e di efflusso (PIN) dell’IAA–.
Nello schema viene anche indicata la partecipazione all’efflusso di IAA– di proteine ABCD e la collocazione dinamica di AUX1 e PIN nella membrana plasmatica, realizzata attraverso il movimento di vescicole eso/endicitotiche.
Si noti che l’auxina indissociata (IAAH) presente nella parte superiore della parete cellulare, dopo la sua dissociazione in IAA– e H+, si lega al suo trasportatore AUX1 (cerchietto verde) presente nella membrana plasmatica, penetra all’interno della cellula veicolata da vescicole endocitotiche (cerchi gialli) che, successivamente, si legano al trasportatore PIN (collocato essenzialmente nella regione basale della membrana plasmatica) il quale, con l’ausilio delle H+-ATPasi, consente l’uscita di auxina indissociata sul lato inferiore della parete cellulare, dove inizia nuovamente il trasporto alla cellula successiva.
Si notino anche i carrier proteici ABCD.
Figura tratta da: N. Rascio, Elementi di fisiologia vege-
tale. EdiSES, Napoli, 2017.
Va precisato che la collocazione dei trasportatori nella membrana non è fissa, ma questi subiscono dei flussi ciclici allontanandosi dalla membrana stessa (veicolati da vescicole) e tornando poi in essa, magari nella nuova posizione richiesta per rispondere a determinati stimoli ambientali.
Ad esempio, nella radice in posizione verticale il carrier PIN3 è distribuito uniformemente nella membrana plasmatica delle cellule della columella ma, in risposta al posizionamento orizzontale della radice, PIN3 subisce una ricollocazione sul lato basso di queste cellule, dirigendo l’efflusso di auxina in quella direzione e generando un gradiente auxinico tra i due lati della radice. Questa ricollocazione è rapida (2-5 min) e avviene attraverso il traffico vescicolare regolato dalla proteina GNOM.
PIN2, invece, nella radice non gravistimolata, è localizzato polarmente nella membrana plasmatica apicale delle cellule laterali della cuffia e delle cellule epidermiche e direziona l’auxina verso la zona di distensione. La stimolazione gravitropica non causa il riposizionamento di PIN2, ma la sua internalizzazione e demolizione in un vacuolo litico nelle cellule del lato superiore della radice: ciò crea sui due lati dell’organo un gradiente di concentrazione del trasportatore che si traduce in un gradiente di flusso auxinico. Quest’ultimo, come si è visto nella Fig. 5, conduce la radice a curvarsi verso il basso.
Nell’attivazione del flusso differenziale di auxina sono coinvolte, nelle cellule della columella, anche il rilascio di ioni calcio (Ca2+) dal reticolo endoplasmatico al citosol Citosol: regione del citoplasma priva di organelli, ricca di proteine, composta di filamenti (che costituiscono il citoscheletro). (per l’apertura di canali ionici meccano-sensibili) e la conseguente trasduzione del segnale. È stato ipotizzato anche un ruolo dei microfilamenti di actina nel percepire la caduta degli amiloplasti; ciò attiverebbe recettori della membrana plasmatica che porterebbero all’apertura dei canali del calcio, partecipando così all’incremento del secondo messaggero (Ca2+) nel citosol. Componente della trasduzione del segnale sarebbe anche il flusso protonico (per attivazione della H+-ATPasi della membrana plasmatica) che alcalinizza il citosol e acidifica la parete cellulare.
– La risposta gravitropica dei fusti
Nei fusti, il segnale di gravità (il cui sito di percezione sono le cellule dell’endoderma: si riveda la Fig. 4) viene trasmesso lateralmente verso la corteccia e l’epidermide e raggiunge la zona di allungamento distale (sito di risposta), ove induce una distensione differenziale nei due lati del germoglio.
Nelle cellule endodermiche il citosol è relegato alla periferia e gli amiloplasti (statoliti) sono imbrigliati sul lato basso del grande vacuolo centrale.
Anche nel fusto posizionato orizzontalmente l’auxina si accumula maggiormente sul lato (divenuto) basso e coinvolge il riposizionamento del trasportatore PIN3 sul lato basso (attraverso il traffico vescicolare regolato dalla proteina GNOM).
Al contrario della radice, però, la maggior concentrazione di auxina stimola (anziché inibire) la crescita per distensione delle cellule del lato inferiore che, crescendo di più di quelle del lato superiore, fanno curvare il fusto verso l’alto facendogli riassumere la corretta posizione ortogravitropica negativa.
Gli studi sui fusti sono però molto più limitati di quelli sulle radici (le sperimentazioni sono state eseguite sull’ipocotile, non sui veri fusti) e non si hanno ancora informazioni certe sulle vie molecolari di trasduzione del segnale.
– La ricezione e la trasduzione del segnale dell’auxina
Resta ora da capire attraverso quali meccanismi l’auxina possa esplicare i suoi effetti sulla distensione delle cellule bersaglio. La maggior parte di questi sono prodotti all’interno delle cellule e sono dovuti alla capacità dell’auxina di indurre una rapida trascrizione di geni il cui promotore contiene elementi di risposta all’ormone.
Anche questi aspetti, essendo di carattere specialistico, saranno appena accennati (si veda lo schema della Fig. 7). Sicuramente il lettore medio capirà ben poco di questi meccanismi, ma certamente quanto basta per restarne incantato.
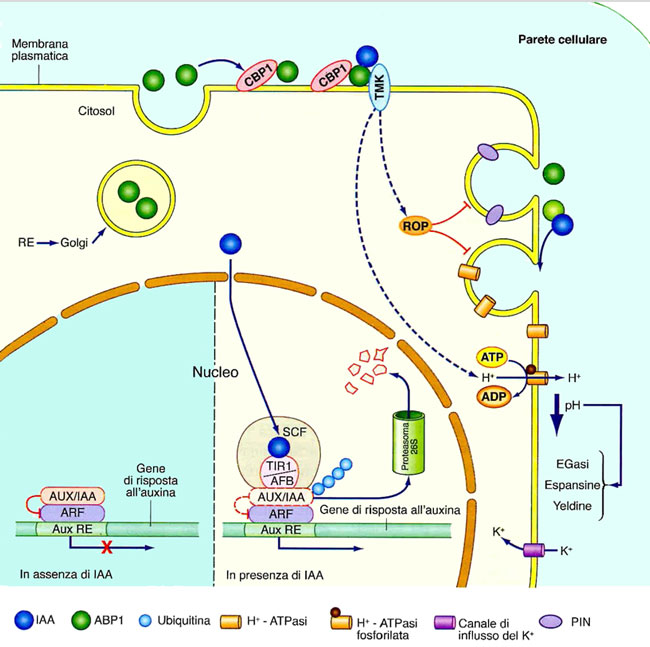 Fig. 7. Schema semplificato della ricezione e trasduzione dei segnali auxinici.
Fig. 7. Schema semplificato della ricezione e trasduzione dei segnali auxinici.Il legame dell’auxina (IAA) con il recettore nucleare TIR 1 / AFB induce l’ubiquitinazione e successiva demolizione nel proteosoma 26S della proteina bersaglio AUX/IAA che, in assenza dell’ormone, reprime l’azione della proteina ARF, un fattore di trascrizione che si lega al promotore di geni con l’elemento di risposta dell’auxina (AuxRE). In seguito alla demolizione di AUX/IAA, ARF, non più represso, può agire sull’espressione di questi geni. Il legame dell’auxina al recettore extracellulare ABP 1, ancorato alla membrana plasmatica dalla proteina CBP 1, porta alla formazione di un complesso con la protein chinasi transmembrana TMK che attiva vie citosoliche di risposta all’ormone. Una di queste vie coinvolge proteine ROP (che agiscono sul traffico vescicolare della cellula) e porta all’inibizione dell’internalizzazione nel citosol di trasportatori PIN e dell’H+-ATPasi. La segnalazione citosolica induce anche l’attivazione (mediante fosforilazione) della H+-ATPasi della membrana plasmatica. L’aumentata estrusione di H+ e la conseguente acidificazione dell’apoplasto induce l’attivazione di enzimi che causano il rammollimento della parete. Nello schema è anche rappresentata l’entrata di K+ nella cellula attraverso canali di influsso attivati dall’iperpolarizzazione della membrana plasmatica.
Figura tratta da: N. Rascio, Elementi di fisiologia vegetale. EdiSES, Napoli, 2017.
Possiamo paragonare l’arrivo dell’auxina sulla membrana plasmatica a quel che avviene lanciando una pallina nel flipper: l’urto su un pilastrino respingente provoca il rimbalzo in una data direzione, seguito da nuovi urti e rimbalzi in altre direzioni ecc. fino al risultato finale. La differenza sta nel fatto che nella cellula le complesse catene di reazione non sono casuali, ma preordinate, anche se restano silenti fino all’arrivo dello stimolo.
Basta infatti l’arrivo di un segnale appropriato (nel nostro caso l’auxina) per scatenare una stupefacente serie di reazioni in rapida sequenza che coinvolge la penetrazione nella cellula di messaggeri molecolari che, viaggiando all’interno di essa, ne attivano altri o ne inibiscono alcuni, e così via, fino al risultato finale che, nel nostro caso specifico, è il rammollimento della parete cellulare che consente la distensione delle cellule e, pertanto, la curvatura del fusto e della radice in risposta ad uno stimolo gravitativo.
Vai all’elenco delle schede delle piante ornamentali
Aggiornamenti:



